Агрегатные состояния вещества
Радость видеть и понимать –
есть величайший дар природы
Альберт Эйнштейн
Данная тема посвящена изучению различных состояний вещества. Известно, что вода может находиться в трех состояниях: твердом, жидком и газообразном. То есть, при достаточно низких температурах вода становится льдом или снегом. И, наоборот, при достаточно высоких температурах, вода превращается в пар. Это, конечно, присуще не только воде, но и другим веществам. Итак, любое тело может быть твердым, жидким или газообразным. В зависимости от состояния, тела обладают различными свойствами. Известно, что твердые тела имеют собственную форму и сохраняет объём. Например, стол или стул – это твердые тела, поскольку они имеют определенную форму, которую сохраняют и занимают определенный объём. Для того чтобы изменить форму твердого тела, нужно приложить большое усилие. Например, практически невозможно согнуть или расплющить монету руками. Однако если по ней ударить молотком, то можно её расплющить. Другой пример: стеклянный стакан тоже сохраняет свой объем и форму. Конечно, стакан довольно легко разбить: чаще всего, достаточно просто уронить его на пол. Жидкости, напротив, легко меняют свою форму. Разумеется, это легко доказать, если переливать воду в емкости различной формы: вода будет принимать форму того сосуда, в который она помещена. Тем не менее, жидкости сохраняют свой объём. Это тоже легко проверить: если наполнить бутылку до краев водой и попробовать перелить эту воду в стакан, который явно поменьше. Можно убедиться, что вода туда не поместится: либо в бутылке останется немного воды, либо вода польётся через край стакана.
Газы не сохраняют ни форму, ни объём. Большинство газов прозрачны и бесцветны, а потому невидимы. Достаточно известен один пример газа – это воздух. Конечно, можно перемещаться по комнате, не испытывая никаких затруднений с дыханием. Значит, воздух заполняет всю комнату.
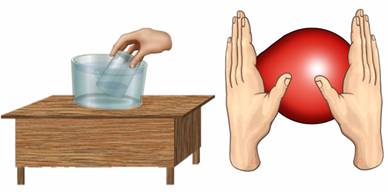
Если попробовать поднять стакан вверх дном и опустить его в воду, то вода его не заполнит. Почему? Потому что там воздух. Ранее был рассмотрен пример с воздушным шариком: можно без труда изменить объём и форму шарика, несмотря на то, что количество газа внутри шарика не меняется. Итак, газы не сохраняют ни свою форму, ни свой объём. Они принимают форму сосуда и заполняют весь предоставленный объём.
Одно и то же вещество может находиться в различных состояниях в зависимости от внешних условий (в основном, это температура).
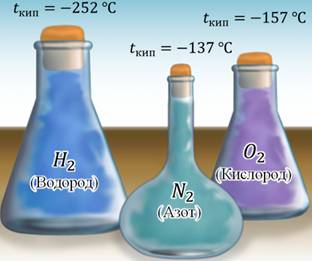
Например, водород закипает уже при температуре минус 252 градуса Цельсия (°С). Конечно, такую температуру на Земле можно получить только в лабораторных условиях и то, это довольно не просто. Газ азот (который является основной составляющей воздуха) становится жидким только при температуре минус 137°С, а кислород – при температуре минус 157°С. Поэтому, данные вещества практически всегда находятся в газообразном состоянии на нашей планете. Металлы – наоборот, почти всегда находятся в твердом состоянии. Дело в том, что для того, чтобы перевести их в жидкое состояние, нужны высокие температуры. Например, чтобы расплавить железо, нужно более полутора тысяч градусов Цельсия. Чтобы расплавить медь нужно нагреть её до температуры около тысячи ста градусов Цельсия. Такие температуры достигаются на различных заводах и фабриках, которые производят изделия из металлов.
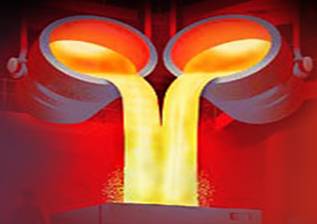
Люди используют свойство жидкости – легко менять свою форму. После того, как металлы переходят в жидкое состояние, их заливают в нужную форму, а потом остужают, чтобы они снова стали твердыми.
Изменение агрегатных состояний вещества постоянно происходит на нашей планете. Это отлично демонстрируется таким явлением, как круговорот воды в природе. Вода испаряется из водоемов, и водяные пары уносятся в атмосферу. Там они остывают, образуя облака и тучи. В конце концов, вода снова переходит в жидкое состояние и возвращается на Землю в виде осадков. Важно понимать, что изменение агрегатных состояний вещества не влечет за собой изменение молекул. Молекулы льда, воды и водяного пара абсолютно одинаковы: они состоят из двух атомов водорода и одного атома кислорода.
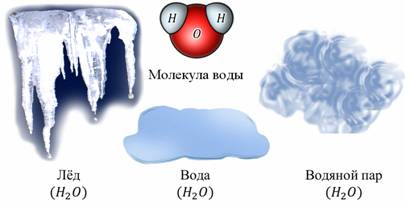
Поэтому, ни в коем случае нельзя путать изменение самого вещества с изменением его состояния. Различные агрегатные состояния вещества определяются расположением молекул, их движением и характером взаимодействия. Но об этом будет подробно рассказано в следующей теме.
Основные выводы:
– Все вещества могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном.
– Твердые тела имеют собственный объём и сохраняют форму.
– Жидкости легко меняют форму, но при этом сохраняют объём.
– Газы не имеют своей формы и занимают весь предоставленный объём (то есть, не сохраняют ни объём, ни форму).
– Вещество переходит в то или иное агрегатное состояние в зависимости от внешних условий.
Различия в молекулярном строении твердых тел, жидкостей и газов
«Свойства тел не случайны,
они зависят от свойств с
оставляющих их корпускул»
М.В. Ломоносов
В данной теме будет продолжен разговор об агрегатных состояниях вещества. Ранее речь шла о трёх агрегатных состояниях вещества – это твердое состояние, жидкое, и газообразное. Было выяснено, что твердые тела сохраняют и объём и форму. Жидкости легко меняют форму, но при этом сохраняют объём. Газы не имеют собственной формы и занимают весь предоставленный им объём. Например, вода на планете Земля встречается во всех трех состояниях. При этом и лёд, и вода, и водяной пар состоят из абсолютно одинаковых молекул. Изменение агрегатного состояния не влечет за собой изменение самих молекул.
Агрегатные состояния характеризуются расположением молекул, движением молекул и взаимодействием молекул. Твёрдые тела сохраняют свою форму и объём. Поэтому, молекулы в твердых телах расположены в строгом порядке и жестко связаны друг с другом. Из-за значительного взаимного притяжения и отталкивания, взаимное расположение молекул твердого тела достаточно сложно изменить. Тем не менее, беспорядочное движение все равно присутствует в твердых телах. Молекулы в твердых телах совершают небольшие колебания, т.е. молекулы двигаются из стороны в сторону, но тут же встречают отталкивание со стороны соседних молекул и возвращаются на свои места.
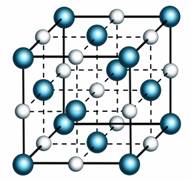
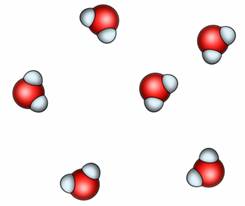
В жидкостях нет никакого определенного порядка расположения. Тем не менее, молекулы жидкости находятся очень близко (практически вплотную) друг к другу, поэтому, жидкости практически несжимаемы. Молекулы жидкости так же, как и молекулы твердых тел, колеблются. Но, помимо этого, они могут совершать перескоки, меняться местами, что, легко может привести к изменению формы. Именно этим и объясняется текучесть жидкостей.

В газах, молекулы находятся друг от друга на расстояниях во много раз превышающих размеры самих молекул. Поэтому, взаимное притяжение и взаимное отталкивание между молекулами газов очень незначительны. Это и приводит к тому, что газы не имеют формы и достаточно легко сжимаются. Поскольку молекулы практически не испытывают ни притяжения, ни отталкивания, они могут перемещаться с очень большими скоростями (по несколько сотен километров в час). Таким образом, в газах нет никакого порядка в расположении молекул.
Для наглядности можно провести некоторые аналогии. В твердых телах молекулы расположены в соответствии со строгим порядком и только колеблются. Это можно сравнить с тем, как ученики сидят на уроке. Ученики расположены в строгом порядке относительно друг друга (то есть сидят на определенных местах по рядам). При этом сидя на своём месте, ученик может совершать некоторые движения.
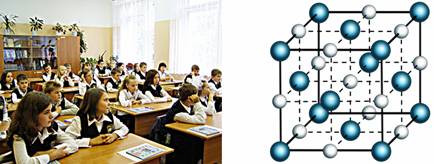
Аналогией жидкости может послужить метро в час-пик. Люди находятся очень близко друг к другу, но, тем не менее, каждый человек может переместиться из одного места в другое (точно так же, как молекула жидкости может перескочить из одного положения равновесия в другое).

Движение газа можно сравнить с движением футболистов. Они бегают по всему футбольному полю с большими скоростями и находятся на большом расстоянии друг от друга.
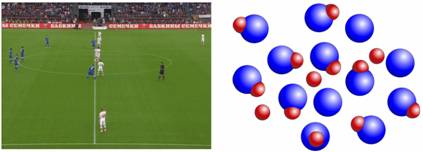
Известно, если нагревать лед, то он со временем, превратится в воду. Если продолжить нагревать воду, то она закипит и превратится в водяной пар. При каждом изменении агрегатного состояния будет изменяться характер движения и взаимодействия молекул. Рассмотрим данные процессы. Во льду молекулы жестко связаны и только колеблются. Когда лед понемногу начинает плавиться, происходит нарушение порядка. Некоторые молекулы уже способны перескакивать со своих мест на другие. В конце концов, порядок совсем нарушится, и молекулы то и дело будут перескакивать с места на место, но все еще находится вплотную друг к другу. По мере нагревания воды, скорости молекул будут увеличиваться. Некоторые молекулы наберут такую скорость, что смогут оторваться от поверхности воды, таким образом, покинув её. Такие молекулы уже будут находиться в газообразном состоянии. В итоге, вся вода выкипит, превратившись в пар. Молекулы теперь уже будут двигаться совершенно беспорядочно, очень слабо взаимодействуя друг с другом.
Данный процесс можно сравнить со школьным процессом. Ученики стоят на линейке. Все ученики стоят в определенном порядке, но никуда не перемещаются (это напоминает поведение молекул льда). Когда линейка заканчивается, ученики начинают расходится. Происходит нарушение порядка, и ученики уже не стоят ровными рядами, а образуют толпу, в которой они могут меняться местами (это уже похоже на поведение молекул жидкости). Далее ученики выбегают в коридор или на улицу, уже находясь на существенном расстоянии друг от друга, и перестают толкаться (то есть, не взаимодействуете с другими, а двигаетесь сами по себе). Это напоминает поведение молекул газа.
Основные выводы:

Домашнее задание
Страница: 33 — 37 читать