Вы хорошо знаете, что одно и то же вещество может находиться в трёх агрегатных состояниях: в твёрдом, жидком и газообразном. Эти состояния вещества различаются расположением, характером движения и взаимодействия молекул. При некоторых условиях, например при определённых значениях температуры и давления, вещества могут переходить из одного агрегатного состояния в другое. Самым известным таким примером служат вода, лёд и пар.

Лёд Вода Пар
Переходы вещества из одного агрегатного состояния в другое называют агрегатными превращениями.
Многие природные явления обусловлены естественным изменением агрегатных состояний различных веществ. Например, хорошо знакомый вам большой круговорот воды в природе, объясняется изменением агрегатного состояния воды.
Конечно же у вас могут возникнуть вопросы: при каких условиях происходит переход вещества из одного агрегатного состояния в другое? Или как объяснить изменение агрегатного состояния вещества?
Давайте попытаемся найти ответы на эти и другие вопросы. Вы уже знаете, что молекулы одного и того же вещества не меняются с изменением его агрегатного состояния. А меняется их расположение, характер движения и взаимодействия.

Твёрдое тело Жидкость Газ
Вспомним, что в твёрдых телах молекулы плотно прилегают друг к другу и могут только колебаться около своих положений равновесия.
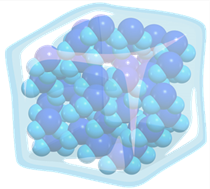
Из-за сильного взаимодействия в твёрдом веществе частиц друг с другом, и отсутствие у них подвижности, приводит к тому, что твёрдые тела сохраняют свою форму и объём.
В жидкостях, молекулы расположены немного дальше друг от друга. Поэтому они совершают беспорядочные колебания и вращения в одном положении, а также могут перемещаться друг относительно друга.
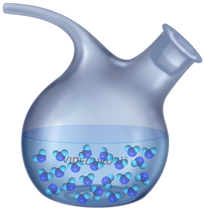
Наличие сил притяжения между молекулами обеспечивает жидкости сохранение объёма, а перемещения — текучесть.
В газах молекулы расположены на значительном расстоянии друг от друга. Поэтому молекула в газе двигается свободно до момента столкновения с другой молекулой или стенкой сосуда, в котором он находится.
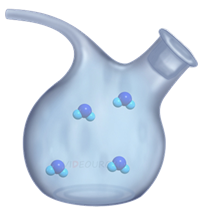
А если газу не мешают стенки сосуда, то его молекулы разлетаются в различных направлениях.
Давайте рассмотрим несколько примеров о том, как люди используют изменение агрегатных состояний веществ в своих целях. Существует такое устройство, как паровая турбина.
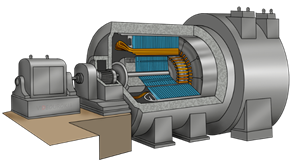
Это тепловой двигатель, в котором за счёт разности давлений энергия пара преобразуется в механическую энергию.
Также, чтобы придать ту или иную форму металлическим изделиям, люди сначала приводят металлы к жидкому состоянию, а потом остужают их.

А, например, сжиженный газ используется в холодильных установках.

На прошлых уроках мы с вами говорили о том, что при теплопередаче изменяется внутренняя энергия тела. И чаще всего это связано с изменением его температуры. Но при этом агрегатное состояние вещества остаётся прежним. Однако существуют процессы, при которых внутренняя энергия вещества при получении теплоты увеличивается, а температура остаётся постоянной.
К таким процессам относятся плавление и кристаллизация (отвердевание). Изучим эти процессы с помощью опыта.
Возьмём калориметр, во внутренний сосуд которого положим немного измельчённого льда при температуре минус десять градусов по Цельсию.
Опустим в него термометр и оставим на столе. Будем следить за изменением температуры льда и процессами, которые с ним происходят. Наблюдения показывают, что какое-то время лёд остаётся в твёрдом состоянии, а его температура постепенно повышается.

При температуре в 0 оС лёд начинает плавиться, в сосуде появляется вода, но температура льда остаётся неизменной. И она не будет изменяться до тех пор, пока весь лёд не перейдёт в жидкое состояние. Только после этого температура образовавшейся изо льда воды начинает повышаться. И это будет происходить до тех пор, пока она не станет равной комнатной температуре.
Такой переход вещества из твёрдого состояния в жидкое называют плавлением.
Из наблюдений можно сделать несколько важных выводов. Во-первых, лёд начинает плавиться при определённой температуре. Важно отметить, что лёд находится в кристаллическом состоянии. Следовательно, процесс плавления кристаллических тел происходит при определённой температуре, которую называют температурой плавления.
Во-вторых, температура льда и образовавшейся воды во время всего процесса плавления остаётся неизменной. Таким образом, во время процесса плавления кристаллического вещества его температура остаётся постоянной.
Процесс плавления любых кристаллических тел протекает аналогично рассмотренному процессу плавления льда. То есть чтобы расплавить твёрдое кристаллическое тело, необходимо нагреть его до температуры плавления и в дальнейшем сообщать ему энергию до тех пор, пока всё оно не превратится в жидкость. Исключение составляют те вещества, которые меняют свой химический состав или сразу превращаются в газ.
Различные кристаллические вещества имеют разную температуру плавления.
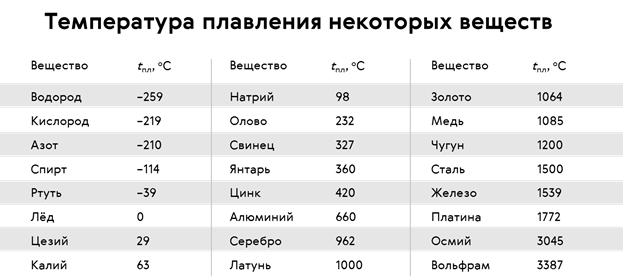
Из таблицы видно, что температуры плавления различных веществ лежат достаточно в широком диапазоне.
Температуру плавления приходится учитывать при создании бытовой и промышленной техники. Так, например, спирали лампочек и нагревательных элементов делают из тугоплавких материалов. А в самолётостроении, в ракетной и космической промышленности используют материалы с очень высокой температурой плавления.
Но вернёмся к нашему опыту с калориметром. Поместим его, вместе с находящейся в нём водой, в морозильную камеру и проследим за изменением температуры воды.

Заметим, что сначала вода будет охлаждаться до 0 оС, отдавая при этом некоторое количество теплоты окружающему воздуху. При этом будет уменьшаться и её внутренняя энергия за счёт уменьшения средней кинетической энергии движения молекул. Когда температура воды станет равной 0 оС, она начнёт превращаться в лёд. При этом температура воды не будет изменяться до тех пор, пока вся она не перейдёт в твёрдое состояние.
Процесс перехода вещества из жидкого состояния в твёрдое называют отвердеванием или кристаллизацией.
Данный процесс сопровождается выделением определённого количества теплоты и соответственно уменьшением внутренней энергии вещества за счёт уменьшения потенциальной энергии взаимодействия его молекул.
Температура, при которой тело отвердевает или кристаллизуется, называется температурой отвердевания или кристаллизации. Эта температура остаётся неизменной во время всего процесса кристаллизации.
Из опыта следует, что для кристаллических тел температура кристаллизации равна температуре плавления.
В заключении отметим, что понятия «температура плавления» и «температура кристаллизации» применимы не ко всем веществам. Например, согрев рукой кусок холодного твёрдого пластилина, мы ощутим постепенное уменьшение его твёрдости. Продолжая нагрев на каком-либо нагревателе, можно перевести пластилин в состояние вязкой жидкости. Но мы не обнаружим определённой температуры плавления. То же самое происходит при нагревании стекла. Наблюдается непрерывное уменьшение твёрдости стекла и увеличение его текучести. Причина такого поведения указанных веществ в отсутствии в их строении правильного повторяющегося расположения частиц. Этот особый вид тел принято называть аморфными телами. Помимо стекла и пластилина, к ним ещё относятся, например, твёрдая смола, сургуч, различного вида пластмассы и так далее.
Поэтому помните, что понятия «температура плавления» и «температура кристаллизации» применимы лишь к телам, имеющим кристаллическое строение.
Домашнее задание
Стр. 36 — 40 читать, упражнение 11 выполнить в тетради